國璽幹細胞於2011年成立幹細胞研製中心,致力於開發幹細胞技術以克服未被滿足的醫療需求 (Unmet medical needs)。幹細胞新藥開發歷程上,我們已建立醫藥級幹細胞製劑生產技術平台、幹細胞激活技術『Nigiro-Med®』、醫藥級幹細胞儲存服務與臨床細胞製劑品質檢測服務。

-
2025.08.22
媒體報導國璽幹細胞攜大馬Cell 101拓亞太再生醫學市場 -
2025.07.04
媒體報導國璽幹細胞赴日拓展再生醫療國際商機 力拼脂肪幹細胞產品國際化 -
2025.06.16
媒體報導高齡化與腦中風年輕化夾擊 國璽幹細胞搶先佈局 -
2025.05.13
媒體報導國璽退化性關節炎幹細胞新藥 獲准啟動台灣臨床三期 -
2025.04.22
媒體報導國璽細胞新藥+CDMO雙軌策略 啖再生醫療雙法商機 -
2025.04.15
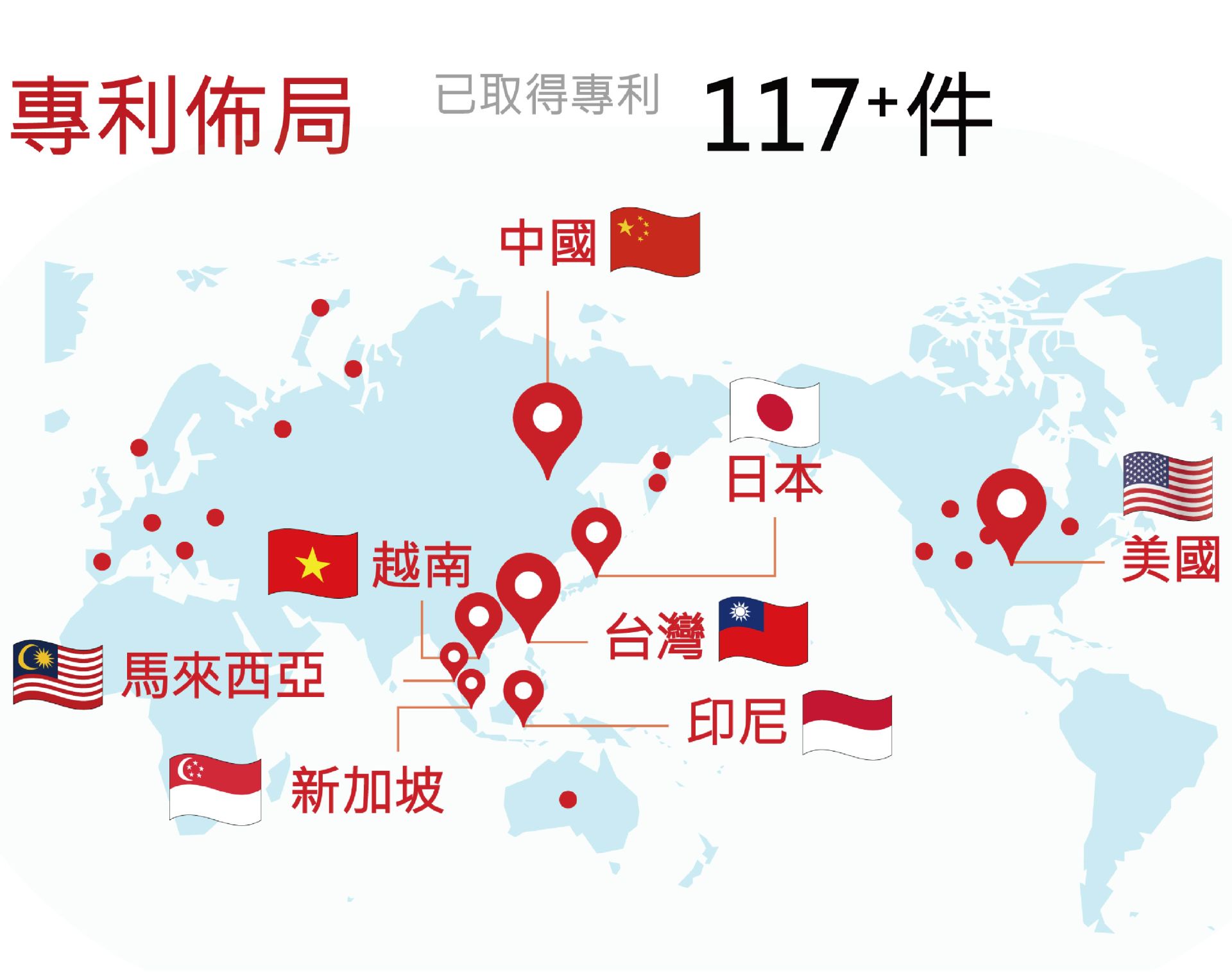
媒體報導國璽臨床製程取得核心專利助力全球市場拓展 -
2025.03.20
媒體報導國璽幹細胞外泌體取得化粧品INCI認證 -
2025.03.12
媒體報導國璽幹細胞糖尿病新藥獲發明專利


-
 29202508國璽專欄
29202508國璽專欄幹細胞治療、外泌體治療屬於藥物嗎?還是技術?
近年來,「幹細胞」與「外泌體」又掀起一波浪潮,市場上充斥著各種產品,但它們到底算藥品?還是技術? 民眾又該如何選擇,品質方面有什麼需要注意?再生雙法有管制到這些產品嗎?
-
 07202508國璽專欄
07202508國璽專欄外泌體生髮效果,雄性禿也免煩惱!
外泌體近期在毛髮再生領域掀起熱潮,成為備受矚目的育髮新科技。外泌體主要透過三大機制來針對毛囊與頭皮健康進行調理。
-
 21202507國璽專欄
21202507國璽專欄什麼是藥物授權?
藥物授權(licensing)是生技製藥產業常見的商業合作模式,是一種讓藥品研發成果加速「變現」的策略。
-
 27202506國璽專欄
27202506國璽專欄認識腦中風:腦中風前兆、症狀、最新治療趨勢
腦中風是全球主要的死亡與失能原因之一,高血壓、糖尿病、高膽固醇等都是主要危險因子,如何預防與及早治療至關重要,黃金治療4.5小時,教你識別中風症狀。
-
 13202506國璽專欄
13202506國璽專欄藥廠為什麼需要專利?對技術有幫助嗎?
藥物從開發到上市需要10年甚至更久的時間,才能真正上市為眾多患者帶來效益,看似平凡的藥劑,背後蘊藏著長時的研發旅程及努力,而專利佈局成了藥廠不可或缺的護身符。
-
 23202505國璽專欄
23202505國璽專欄寵物健康新趨勢:外泌體的神奇力量!
外泌體在寵物健康管理中展現雙重優勢,除了可作為非侵入性檢測疾病工具,更聚焦幹細胞分泌的外泌體修復組織、調節免疫與抗發炎的潛力,為毛孩們帶來全新的醫療選擇!
-
 09202505國璽專欄
09202505國璽專欄外泌體產品怎麼選?3個簡單步驟教你識別好成分!
越來越多的護膚品牌將外泌體技術應用於產品中,推出針對抗衰老、美白、修復等多功能護膚品。面對市場上琳琅滿目的產品,以下3個簡單步驟,幫助你快速識別好成分,輕鬆選購!
-
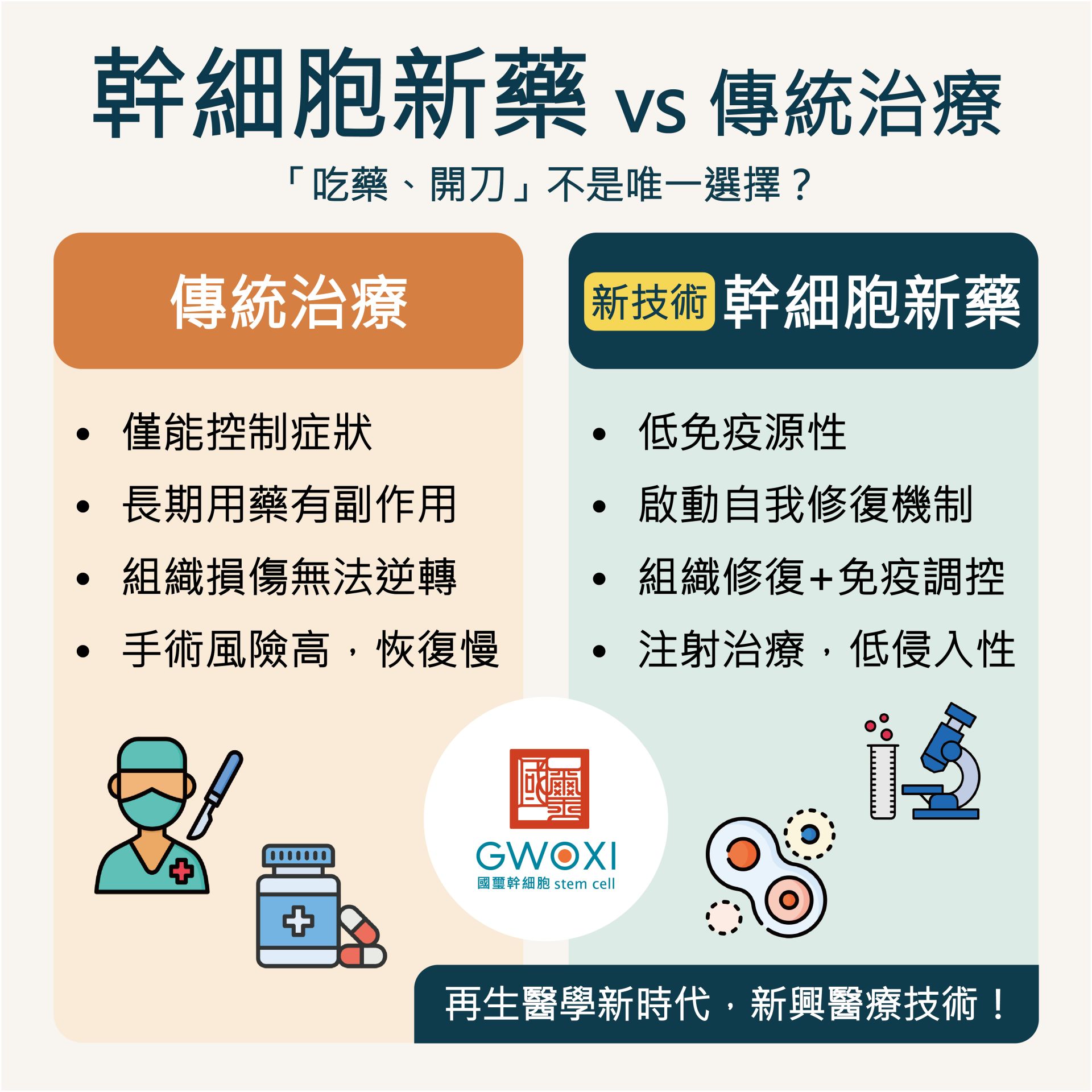 25202504國璽專欄
25202504國璽專欄幹細胞新藥與傳統治療的差別?
隨著醫學科技的進步,人類對疾病的治療方式也在不斷演變。傳統醫療方法,如藥物治療、手術等。
-
 28202503國璽專欄
28202503國璽專欄為什麼會得關節炎?可以治好嗎?
生活中過度使用關節、姿勢不良、體重過重或是肌力不足等情況,皆會增加退化性關節炎的罹患率,隨著老化加速疾病惡化,嚴重者甚至造成患者生活品質嚴重下滑。
-
 21202503國璽專欄
21202503國璽專欄INCI Name 是什麼?幹細胞外泌體也能成為化粧品原料?
目前國際已有多家生技公司之幹細胞外泌體通過 INCI Name 審查並取得認證,值得注意的是,然而各家外泌體的製程皆有一定程度的差異性,產品在上市前仍須進行安全性評估。
-
 28202502國璽專欄
28202502國璽專欄從無到有!幫助品牌進軍再生醫學市場
隨著再生醫學的蓬勃發展,幹細胞技術正從醫療領域擴展到生活日常,國璽幹細胞將再生醫療產業鏈垂直整合,開創CDMO/OEM等合作模式,協助合作夥伴加速產品進入市場。
-
 14202502國璽專欄
14202502國璽專欄什麼是生物反應器?幹細胞能大量製造嗎?
生物反應器 (Bioreactor) 為生物製劑在製程放大 (scale-up) 的關鍵設備,製程中須考慮的因素相當複雜,例如細胞特性、環境溫濕度、剪切力、培養基配方等都會影響細胞的生長。
-
 08202501國璽專欄
08202501國璽專欄2024 細胞治療大事蹟
細胞治療的案件數逐年成長,從免疫細胞治療癌症到幹細胞治療退化及組織損傷,細胞治療的廣泛性潛力仍然可期,願再生醫療逐步成為常規醫療的一環。
-
 20202412國璽專欄
20202412國璽專欄台灣再生醫療雙法進度到哪了?
根據衛福部長邱泰源於2024年12月16日表示,預計 2025 年第 1 季將預告「再生醫療法」9項子法,「再生醫療製劑條例」7項子法部分正在蒐集各界意見中。
-
 19202411國璽專欄
19202411國璽專欄不同種類的外泌體及其應用
幹細胞外泌體以其卓越的修復能力在臨床應用突出,植物外泌體則在天然護膚和抗氧化方面發揮作用,而癌細胞外泌體在癌症檢測中具有巨大潛力,不同類型的外泌體具有不同的應用潛力。
-
 25202410國璽專欄
25202410國璽專欄外泌體的純化與分析技術:基於MISEV2023的指導準則
《MISEV2023》針對外泌體的研究提出了詳細的純化和分析指導準則,以確保一致性和結果的可靠性。透過多層次的純化技術和精準的分析方法,能更準確地蒐集與鑑別外泌體。